DEVIATION HANDLING
di tulis oleh Ariyono W Ardi , Drs. Apt. MM .pada 24 Oktober 2022
Penyimpangan (Deviation)
- Kejadian tak terduga yang terjadi selama proses operasi, ,dokumentasi, proses penerimaan dan penyimpanan (bahan baku, bahan kemas, produk antara serta produk jadi), proses pembuatan, proses analisa dan distribusi produk obat yang tidak sesuai dengan standard operating procedure dan atau spesifikasi yang telah ditetapkan
- Kegagalan dalam mengikuti SOP atau memenuhi spesifikasi yang telah ditetapkan
- Penyimpangan (deviation) harus dilaporkan segera ketika terjadi dan dianalisa untuk menilai dampak yang ditimbulkannya
- Penyimpangan/deviation biasa disebut juga sebagai ketidaksesuaian (Non-conformity/ Non-conformance)
Cakupan Penyimpangan (Deviation)
Penyimpangan terkait dengan:
- Limit dan spesifikasi
- Kesalahan penerapan c-GMP
- Reprocessing/ Rework
- Perubahan (Change) yang tidak disetujui
- Pelaksanaan aktifitas GMP tanpa pelatihan yang memadai.
- Parameter proses/ In-process control diluar limit
- Kegagalan dalam emngimplementasikan procedure secara benar.
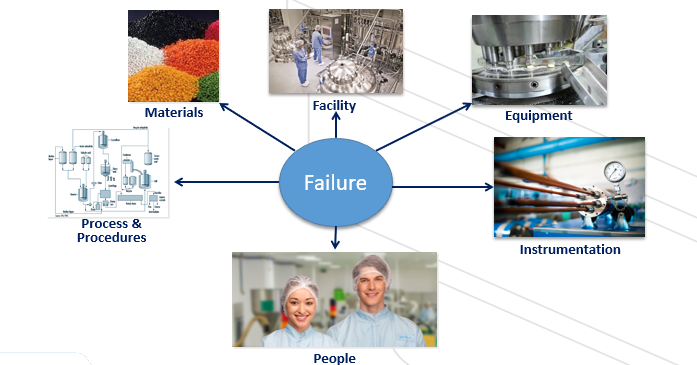
Kontributor Penyimpangan (Deviation)
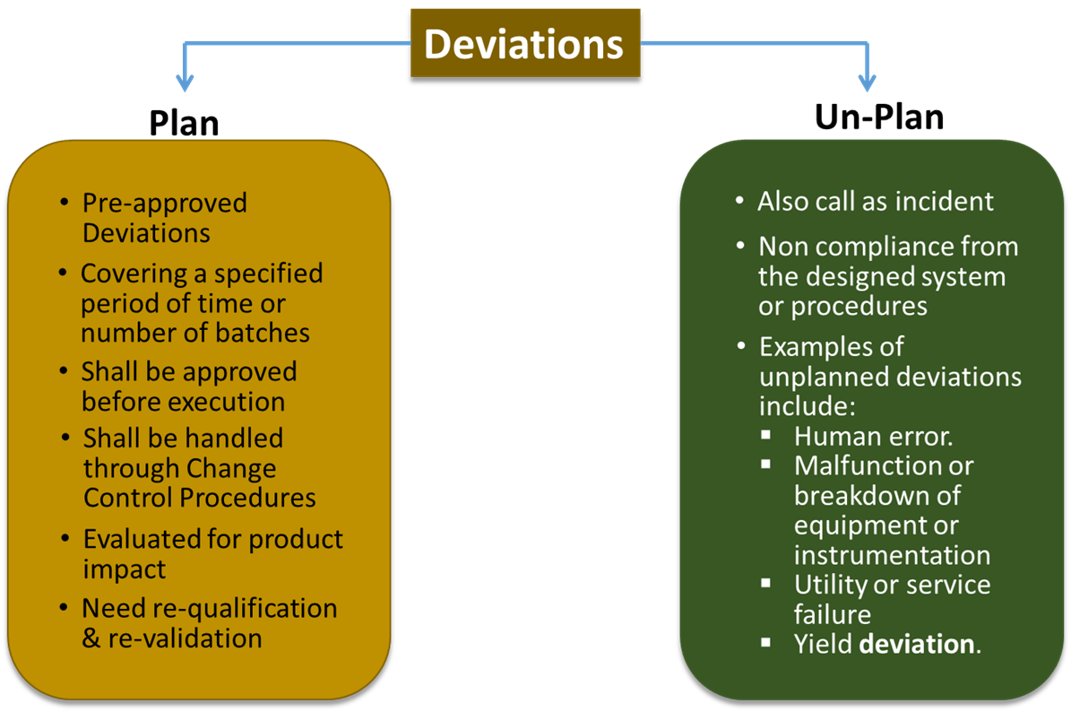
Tipe Penyimpangan
Pada umumnya penyimpangan (deviation) dikelopmpokan dalam2 (dua) golongan:
- Penyimpangan yang terencana (Planned Deviation).
- Penyimpangan yang direncanakan adalah penyimpangan sementara dari protokol atau proses yang ada dimana penyimpangan ini harus disetujui terlebih dahulu sebelum dilaksanakan
- Direncanakan sebelum dilaksanakan dengan berbagai justifikasi ilmiah yang memadai.
- Hanya diperbolehkan digunakan dalam rentang waktu tertentu atau untuk sejumlah bets tertentu
- Penyimpangan yang direncanakan ini boleh berdampak pada kualitas (quality), keamanan (safety), kemanjuran (efficacy) dari produk obat
Contoh :
- Mengurangi ukuran bets dikarenakan keterbatasan bahan baku
- Perubahan supplier excipients
- Menunda calibrasi atau validasi karena suatu alasan tertentu
Deviation Process Flow

- Penyimpangan yang tidak terencana (Un-planned Deviation)
- Penyimpangan yang tidak direncanakan adalah ketidakpatuhan terhadap protokol atau sistem yang telah disetujui yang terjadi pada setiap tahap siklus hidup produk (life cycle) , termasuk pembuatan, pengujian, pengemasan, dan penyimpanan.
- Penyimpangan yang tidak direncanakan juga disebut sebagai kejadian yang tidak direncanakan, atau kejadian yang tidak terkendali.
- Dapat diakibatkan karena human error, kegagalan utilitas, kerusakan atau kegagalan fungsi mesin/instrument.
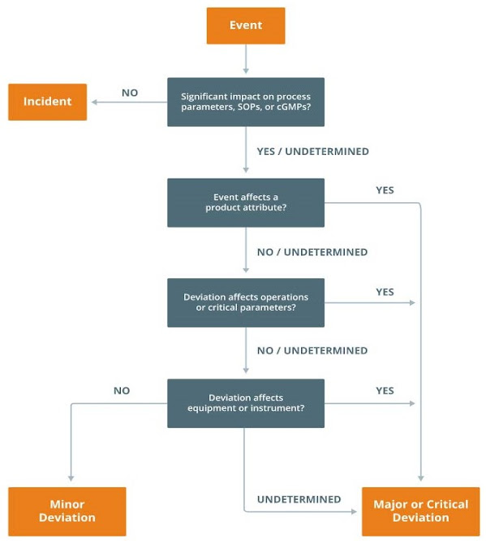
Klasifikasi Penyimpangan
- Incident
Penilaian kajian risiko yang sederhana untuk mendifinisikan penyimpangan “Incident” yaitu dengan menjawab pertanyaan-pertanyaan berikut ketika suatu deviasi ditemui:
- Akankah penyimpangan tersebut mempengaruhi quality atribut produk, parameter operasional, atau kualitas produk?
- Apakah penyimpangan tersebut bertentangan atau menghilangkan persyaratan dalam prosedur atau spesifikasi tertulis yang disetujui?
Jika jawabannya TIDAK untuk pertanyaan a) dan b) di atas, penyimpangan tersebut dapat dianggap sebagai Insiden (peristiwa yang tidak relevan dan tidak memengaruhi kualitas produk)
Penyimpangan yang tidak berdampak langsung pada kualitas produk, walaupun demikian penyimpangan ini melanggar aturan CPOB (c-GMP)
Contoh :
- Personel yang tidak berwenang berada di area produksi
- Bahan baku tumpah di area produksi
- Personel mengenakan gowning di ruang produksi yang tidak sesuai dengan Standard Operating Procedures
- Minor
Penyimpangan yang tidak mempengaruhi atribut kualitas, parameter proses kritis, atau peralatan atau instrumen penting untuk proses atau kontrol
Contoh :- Kesalahan minor pada catatan bets atau dokumen kualitas lain yang tidak berdampak pada data integritas.
- Tumpahnya bahan baku saat proses penimbangan/dispensing
- Kegagalan dalam memenuhi kondisi lingkungan sesuai dengan yang ditetapkan saat pengolahan bets.
- Penggunaan konsep FEFO(First Expired First Out) pada penanganan material.
- Penggunaan timbangan diluar toleransi untuk menimbang bahan baku saat penerimaan di gudang
- Major
Penyimpangan yang dapat berdampak sedang pada kualitas produk atau Sistem GMP
Contoh :
- Kerusakan mesin saat proses pengolahan bets
- Mix-up karton dari produk yang sama dengan kekuatan yang berbeda
- Use of unapproved reference standard to test an API or drug product.
- Inadequately trained personnel to perform sterility tests.
- Production started without line clearance.
- Filter integrity test has been carried out using equipment with no documented installation qualification completed.
- Gross misbehavior of staff in a critical aseptic process.
- Pressure differential out of established limits in aseptic fill areas.
- Operational parameter out of range for a parameter defined as non-critical.
- Untrained personnel responsible for segregating the approved and rejected raw material in the warehouse
- Kritikal
Deviasi yang berdampak kritis pada kualitas produk atau system GMP
Contoh :
- Kontaminasi silang atau product Mix-Up
- Kegagalan proses selama proses pengolahan bets
- Menggunakan catatan bets atau metoda uji yang absolut
- Kegagalan uji integritas filter
Flowchart berikut dapat membantu dalam memahami klasifikasi penyimpangan
DEVIATION MANAGEMENT PROCESS FLOW
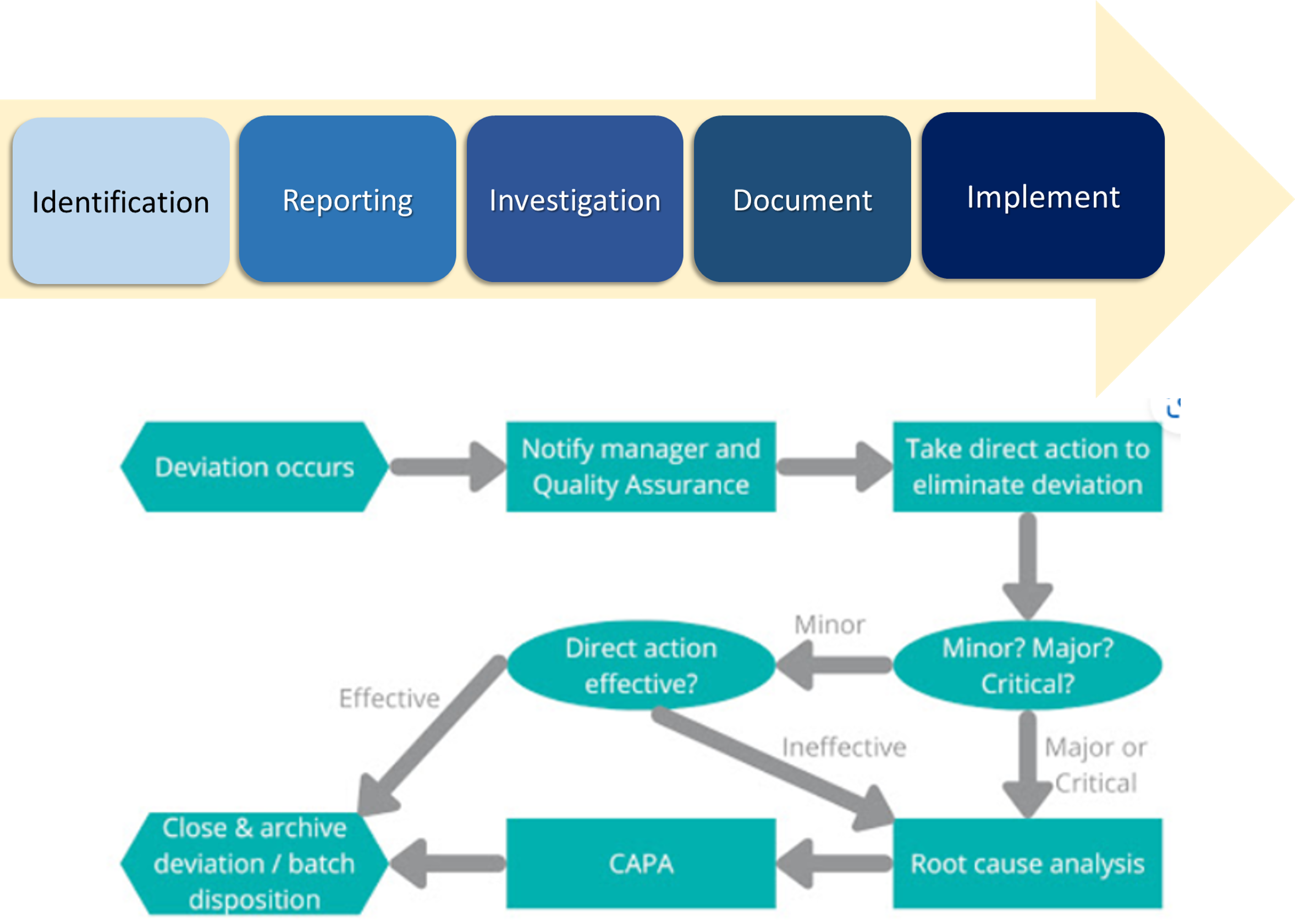
- Identifikasi
- Pertama-tama harus diketahui dengan jelas gambaran penyimpangan yang terjadi
- Semua penyimpangan/deviasi harus diregistrasi dan ditangani dengan benar oleh team yang bertanggung jawab terhadap kajian resiko mutu (Quality Risk Management)
- Kumpulkan semua informasi yang relevan kemudian lakukan kategorisasi jenis penyimpangan (Minor, Major, Critical).
- Registrasi menggunakan penomoran yang spesifik:
- DN/YYYY/ZZZ
- DN: Deviation Number
- YYYY: Tahun (spt: 2022)
- ZZZ : Nomor Urut
- Reporting
- Organisasi harus dapat melacak semua penyimpangan yang terjadi dan memiliki kebijakan untuk melaporkannya segera jika deviasi terjadi.
- Deviasi yang terjadi dicatat dan dilaporkan oleh departemen dimana penyimpangan itu terjadi.
- Semua personel yang terkait dalam penanganan deviasi harus memberikan semua informasi yang relevan untuk membantu investigasi
- Investigation
Failure Analysis
Analisis kegagalan adalah investigasi yang dilakukan untuk menentukan penyebab kegagalan dari suatu proses/ testing/ produk tertentu untuk mencegah terulangnya di masa depan.
Tujuan
- Mengetahui bagaimana proses/test/product tsb. gagal (Failure Mode).
- Dimana kegagalan produk terjadi? (Failure Site).
- Identifikasi fenomena fisik yang terlibat dalam kegagalan (Failure Mechanism).
- Menentukan akar masalahnya (titik pemicu yang menyebabkan kegagalan).
- Merekomendasikan Metode Pencegahan Kegagalan (CAPA).
- Setelah penyimpangan diidentifikasi dan dilaporkan tentukan apa yang menjadi akar masalah.
- Jika penyimpangan dikategorikan sebagai penyimpangan kritis “Root Cause Analysis” diperlukan.
- Departemen yang terkait bekerja sama dengan Pemastian Mutu yang akan melaksanakan “Root Cause Analysis”.
- Jika penyimpangan dikategorikan sebagai “Incident” atau “Minor” “Root Cause Analysis” tidak diperlukan.
- Setelah “Root-Cause Analysis” dilengkapi, Langkah selanjutnya Rencanakan & buat CAPA.
- Setelah bagian “Pemastian Mutu” menyetujui CAPA department dimana terjadi penyimpangan bertanggung jawan untuk mengimplementasikan CAPA hingga selesai.
Investigasi dari suatu penyimpangan (deviation) tidak boleh bias sejak dari awal penanganannya
- Dari perspektif GMP, tujuan melakukan investigasi penyimpangan bukanlah "untuk me-release" batch.
- Tujuan sebenarnya dari investigasi penyimpangan adalah untuk:
- Menentukan "Akar-Penyebab" (“Root Cause”) terjadinya penyimpangan.
- Menerapkan tindakan korektif yang tepat dan akurat.
- Evaluasi sistem yang terdampak, setelah pola penyimpangan berulang dicatat dan dianalisa.

Masalah umum dalam investigasi

- Documentation
- Setelah investigasi terhadap penyimpangan yang terjadi telah diselesaikan dokumentasikan “Root Cause Analysis” dan CAPA untuk tujuan penelusuran (Tracking).
- Jika penanganan deviasi ditangani secara elektronik audit trail perlu dicetak untuk keperluan regulator.
- Audit Trail : catatan yang memuat kronologi yang terkait dengan Tindakan yang dilakukan, informasi lengkapmengenai penyimpangan, perubahan yang terjadi, termasuk “Root Cause Analysis” dan CAPA.
- Implementation
Setelah CAPA disetujui oleh QA implementasikan CAPA sesuai jadwal/waktu yang telah disepakati
Keterkaitan Sistem

PROSEDUR PENANGANAN DEVIASI
STEP # 1: Deskripsikan Penyimpangan
Deskripsikan penyimpangan secara detail.
Jelaskan, apa, dimana, dan kapan deviasi terjadi. Dinyatakan secara sederhana dan faktual. Ini terdiri dari dua atau tiga kalimat yang tidak mengandung teori atau kesimpulan yang diusulkan.
Example, “On 21 Jun 2017 during the manufacture of Vanilla API Lot XYZ123, in manufacturing suite 401, it was observed that the material was clumping and not passing through the sieve on shaker machine #ABC1234.”
Investigasi
Mulai investigasi dengan menjawab pertanyaan berikut:
- Apa yang ditemukan?
- Siapa yang terlibat?
- Kapan peristiwa penyimpangan itu terjadi?
- Di mana penyimpangan itu terjadi?
- Bagaimana penyimpangan itu ditemukan?
- Seberapa sering penyimpangan itu terjadi?
Perbedaan BESAR antara Apa yang Terjadi vs Mengapa atau Bagaimana Sesuatu Terjadi
STEP # 2: Pengumpulan Data
Pengumpulan data merupakan tahap yang kritis dalam mencari akar masalah
- Dikerjakan secara objective
- Mengumpulkan data tanpa bias memberikan kemungkinan terbaik untuk menentukan dengan tepat akar penyebab masalah yang paling mungkin.
- Data-data yang diambil antara lain:
- Nomor bets/lots
- Kondisi lingkungan tempat terjadinya deviasi
- Nama personel yang terlibat
- Catatan bets, catatan hasil uji
- Catatan-catatan atau hasil pengukuran bahan baku
Informasi penting dalam pengumpulan data
- Apakah lingkungan merupakan penyebab masalah?
- Apakah kondisi kerja sesuai?
- Apakah ada masalah pada tahapan proses?
- Apakah ada masalah pada fasilitas?
- Apakah ada masalah peralatan dan bahan baku?
- Apakah petunjuk operasional jelas?
- Apakah ada masalah komunikasi dengan personil atau pelatihan personil?
- Apakah terdapat supervise yang mencukupi?
- Apakah ada masalah dengan metode, sops, prosedur kerja atau metoda analisis?
- Apakah proses/prosedur mengalami perubahan?
STEP # 3: Analisa Akar Masalah (“Root Cause”)
- Setelah data dikumpulkan, analisis akar penyebab dilakukan.
- Ada beberapa tahapan yang dapat dilakukan untuk melakukan RCA.

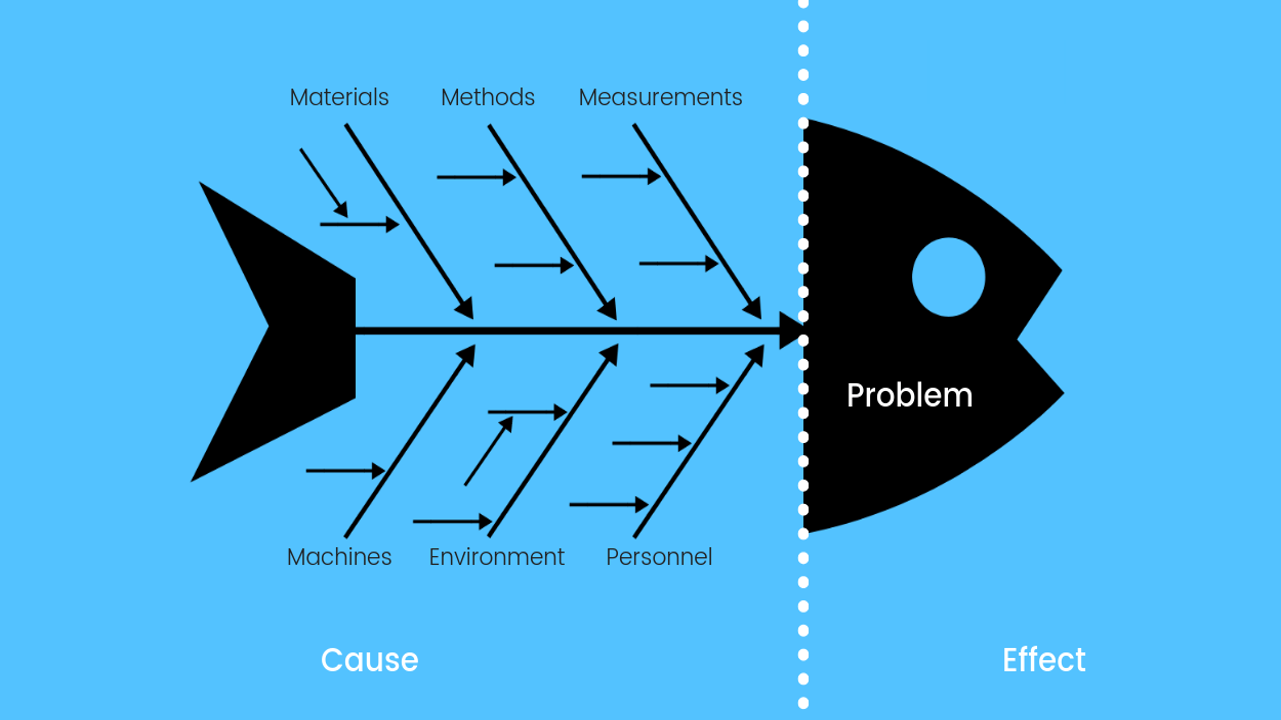
Cause Analysis
- Equipment
- Design, Capability
- Maintenance
- Operator Error
- Procedures
- No Procedure
- Wrong procedure used
- Procedure difficult to be used
- Training
- None
- When
- Effectiveness
- Management System
- Qualified Supervision
- Audits
- Feedback
- Corrective Action
- Planning
- Process Capability
- Adequate time to perform Task
- Standard
- Quality Control
- Inspection Required
- Inspection Performed
Personil
- masing-masing individu dalam proses
- Variasi kemampuan/ kompetensi antar personil
- Evaluasi kemampuan karyawan untuk memastikan bahwa tahapan prosedur telah dilakukan dengan benar
Metoda
- Jelaskan bagaimana tahapan proses dilakukan.
- Apakah kebutuhan spesifik dari proses?
- Apakah ada langkah-langkah critical-to-quality (CTQ) yang terlibat?
- Metoda pengembangan yang terkait dengan proses produksi.
- Adanya perubahan kritis yang terjadi pada proses yang berdampak pada kualitas produk.
- Validasi
- Data trend mengenai adanya penyimpangan
Mesin & Peralatan
- Identifikasi alat dan mesin produksi, sarana penunjang produksi (HVAC, Water Purification System, Compressed Air, Steam) dan alat/instrument uji yang diperlukan untuk proses produksi.
- Periksa catatan kalibrasi
- Periksa catatan perawatan mesin.
- Periksa laporan kualifikasi (KI/KO/KK)
- Periksa kemungkinan adanya perubahan kritis (Change Control)
- FAT/SAT
Bahan Baku
- Periksa sertifikat hasil Analisa (CoA) dari bahan baku
- Periksa kemungkinan adanya “Mix-up”
- Periksa kemungkinan adanya “Cross-Contamination
- Periksa laporan uji stabilitas
- Periksa kemungkinan adanya kerusakan terhadap primary packaging material.
Alat/Instrumen Ukur
- Data apa yang dihasilkan dari alat/instrument ukur yang digunakan untuk mengevaluasi kualitas produk?
- Data Kalibrasi
- Preventive Maintenance
- Kualifikasi (KI/KO/KK)
- System Suitability
Pemantauan Lingkungan
Mengidentifikasi kondisi untuk operasi:
- Suhu dan kelembaban
- Perbedaan tekanan antar ruang
- Pengukuran jumlah kontaminan (Viable & Non-viable)
- Arah alir udara (laminar/ turbulens)
- Pergantian udara/jam
- Room Recovery
Tool Lain Untuk Mencari Akar Masalah
“5 Why’s
- Five Whys adalah teknik yang digunakan untuk mengeksplorasi hubungan sebab-akibat.
- Setiap pertanyaan "Mengapa" harus menjadi dasar untuk pertanyaan berikutnya.
- Jawaban terakhir harus menunjukkan penyebab kegagalan atau cacat proses.
- Tujuan dari 5 whys adalah untuk menentukan akar penyebab cacat atau masalah
- Kecenderungan penyelidik untuk berhenti pada penemuan gejala daripada sampai ke akar penyebab masalahnya.
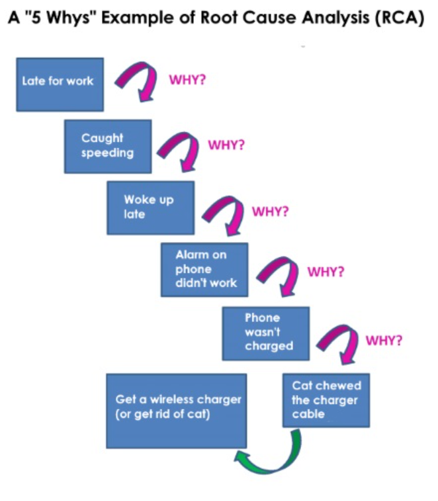
Tool Lain Untuk Mencari Akar Masalah
“5 Why’s
Contoh :

Tool Lain Untuk Mencari Akar Masalah
Pareto Analysis
Analisis Pareto didasarkan pada Prinsip Pareto yang terkenal, yang menyatakan bahwa 20% dari pekerjaan yang dilakukan akan menghasilkan 80% dari hasil yang dicari.
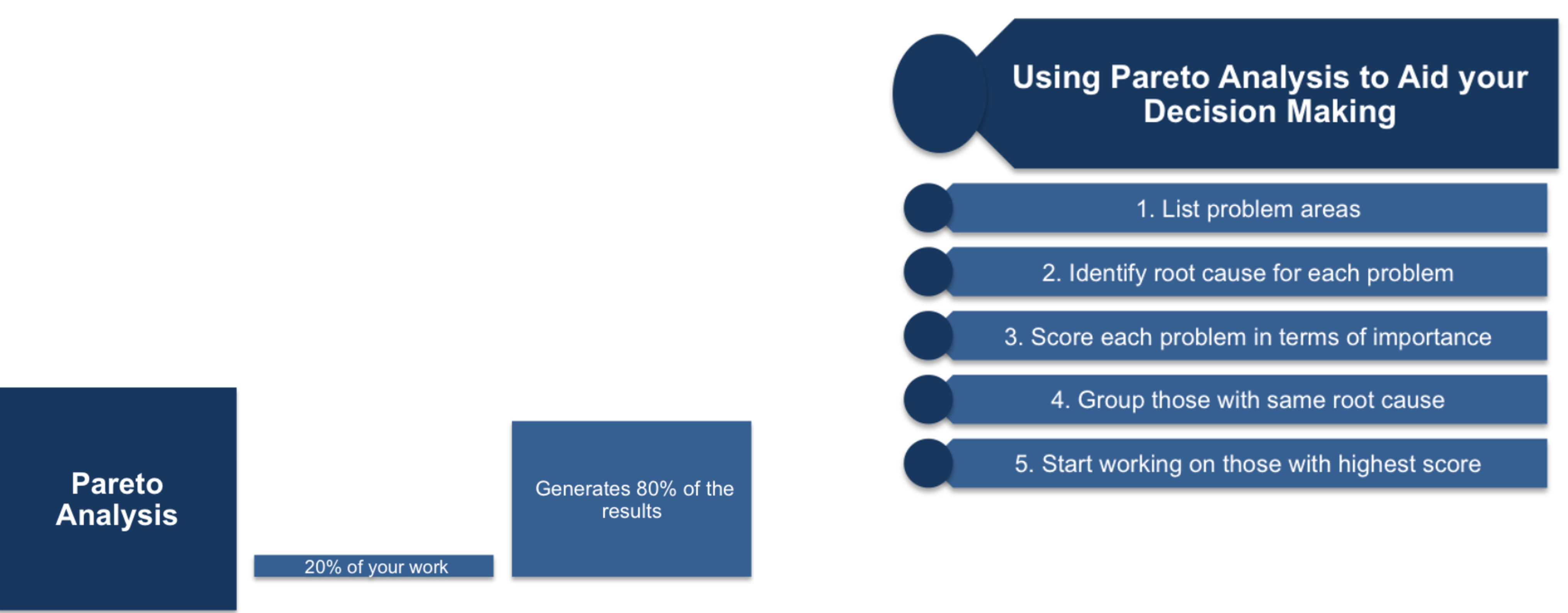


STEP # 4: Impact & Risk Assessment Analysis
- Setelah akar penyebab ditentukan, lakukan penilaian/ kajian dampak dan risiko.
- Mempertimbangkan dampak penyimpangan tersebut pada produk atau sistem mutu dan bagaimana hal itu berkaitan dengan produk atau sistem mutu lain.
- Banyak pendekatan dan alat yang dapat digunakan untuk menilai dan mengelola kajian risiko, seperti:
- Failure mode and effects analysis (FMEA)
- Fault tree analysis (FTA)
- Hazard analysis and critical control points (HACCP)
- Hazard operability analysis (HAZOP)
- Preliminary hazard analysis (PHA)
apakah kajian risiko dapat menjawab pertanyaan-pertanyaan berikut:
- Apa yang mungkin salah?
- Apa kemungkinan yang menjadi penyebab salah?
- Apa konsekuensinya (severity)?
- Selanjutnya, beri peringkat risiko berdasarkan tingkat severity, likelihood, dan detectability (RPN).
- Identifikasi tingkat keparahan risiko yang sesuai sebagai Critical, Major, atau Minor
- Menentukan kemungkinan terjadinya risiko sebagai sangat mungkin (very likely), mungkin (likely), atau tidak mungkin (not likely).
- Tentukan probabilitas deteksi dengan mengklasifikasikan risiko sebagai mudah ditemukan (easily found), agak sulit ditemukan (somewhat hard to find), atau sulit ditemukan (hard to find).
- Berdasar tingkat keparahan (severity), tingkat frekuensi risiko (risk frequency level), dan kemungkinan deteksi (probability of detection), tentukan tingkat risiko total (RPN= Risk Priority Number).
- Setelah tingkat risiko total ditentukan (RPN), tim assesor mengidentifikasi strategi remediasi mana yang terbaik dan merancang tindakan spesifik (CAPA) untuk mengimplementasikan strategi yang telah disepakati.
STEP # 5: Membuat CAPA
Corrective Actions (CAs)
- Suatu tindakan yang diambil untuk menghilangkan akar penyebab dan gejala dari penyimpangan atau ketidaksesuaian yang ada serta untuk mencegah kejadian tersebut terulang kembali.
- MerupakanTindakan Reaktif dalam menghilangkan masalah yang diidentifikasi dalam produk, layanan, atau proses serta menangani perbaikan masalah secara langsung
Preventive Actions (PAs)
- Merupakan tindakan yang diambil untuk menghilangkan potensi penyebab ketidaksesuaian, cacat, atau situasi lain yang tidak diinginkan serta untuk mencegah terjadinya kesalahan yang berulang.
- Merupakan TINDAKAN PROAKTIF untuk menghindari penyimpangan serta menghindari terulangnya masalah yang sama timbul Kembali..
Immediate Action
Contoh:
- Produk : Karantina, Isolasi, Destruksi
- Mesin/Alat : Pindahkan dari ruang operasi dan ganti
- Proses : proses, testing dihentikan.
- CAPA diambil untuk menghilangkan akar penyebab penyimpangan, dan harus didasarkan pada investigasi yang objektif dan benar.
- Tindakan korektif (CAPA) harus disetujui QA sebelum diterapkan dan efektifitasnya diverifikasi dan terdokumentasi.
- Jika CAPA didesign dengan benar, sistem CAPA akan dapat mencegah terjadinya penyimpangan/kesalahan yang berulang
STEP # 6: Pembuatan Kesimpulan
Bagian Kesimpulan merangkum peristiwa, akar penyebab (“Root Cause”), dampak, dan penilaian risiko dengan mengacu pada tindakan korektif atau pencegahan.
STEP # 7: Pemeriksaan Efektifitas (PE) CAPA
- Jika CAPA diperlukan, pemeriksaan efektivitas perlu dilakukan.
- Tujuan EC adalah untuk mengembangkan pemantauan internal yang akan menghasilkan metrik untuk mengevaluasi seberapa sukses investigasi peristiwa dikelola dan seberapa mampu CAPA dapat menangani akar penyebab penyimpangan secara memadai.
Hal ini termasuk:
- Evaluasi apakah penyimpangan yang sama terjadi lagi dalam kurun waktu tertentu.
- Cara perbaikan berkelanjutan yang bagaimana yang dapat mencegah terjadinya pengulangan penyimpangan yang sama.
- Ada berapa penyimpangan yang diakibatkan oleh kurangnya pelatihan karyawan
Evaluasi Efektifitas CAPA meliputi:
- CAPA diselesaikan dan diimplementasikan tepat waktu
- CAPA efektif dalam mengurangi terjadinya kesalahan/penyimpangan yang sama
- Periksa apakah CAPA telah diimplementasikan secara benar.
- Tentukan sumber data yang diperlukan untuk evaluasi secara efektif
- Tentukan periode evaluasi
- Tentukan parameter sukses (Success Criteria)
- Evaluasi dari efektifitas CAPA dilakukan dalam rentang 60 hari sejak CAPA diimplementasikan.
Studi Kasus
Produk Vit C Tablet Effervescent, pack in strip, Batch No. : DI-120817, Produksi : Agustus 2017, pada November 2018 ditemukan perubahan warna di Bandung (20 Strip), Bogor (120 Strip), Samarinda (80 Strip). ), Papua Barat (30 Strip) dan Palembang (25 Strip).
Siapkan Laporan Investigasi Kegagalan untuk mengidentifikasi akar penyebab dan untuk menemukan Tindakan Korektif dan Pencegahan untuk mencegah terulangnya peristiwa ini.
Formulasi
Effervescent terdiri dari asam organik terlarut dan garam karbonat logam alkali, salah satunya sering API. Karbon dioksida terbentuk jika campuran ini bersentuhan dengan air.

Penanganan Material Bahan
- utama yang digunakan dalam pembuatan effervescent relatif higroskopis, menyerap kelembaban dari udara. Ini harus dicegah karena akan memulai reaksi effervescent.
- Strategi prinsip yang digunakan untuk mengatasi masalah ini adalah sistem penanganan material yang benar-benar tertutup, yang mencakup wadah curah menengah (IBC), stasiun dok, dan teknologi katup terpisah
- Udara yang berventilasi harus mengandung kadar air yang cukup rendah.
- Bahan yang dimasukkan ke dalam pengepres harus memiliki sifat yang mencegah pemisahan dan memastikan pengisian cetakan yang homogen, untuk menghasilkan tablet dengan berat yang sama. Pendekatan yang paling umum untuk mencapai bahan dengan karakteristik ini adalah dengan menggranulasi bahan baku. Namun,Metode kering, seperti slugging, kompresi langsung dan pemadatan rol secara teratur digunakan untuk menghasilkan bentuk sediaan padat. Ini adalah metode yang disukai untuk memproduksi effervescent karena tidak ada cairan yang terlibat, tidak diperlukan langkah pengeringan tambahan. Namun, argumen utama yang menentang penggunaan metode kering adalah kebutuhan eksipien yang mahal.
- Granulasi Basah
- Untuk proses granulasi basah, dua langkah granulasi terpisah dijalankan (masing-masing satu untuk komponen basa dan asam) dengan langkah pencampuran kering berikutnya
- Proses pencampuran dapat menjadi langkah kritis dan dapat mempengaruhi homogenitas tablet karena tidak semua bahan-bahan tersebut diikat menjadi satu butiran seperti dalam proses granulasi basah konvensional.
- Reaksi effervescent hanya dimulai jika bahan bersentuhan dengan air - dan tidak jika bersentuhan dengan pelarut organik
- Untuk proses granulasi basah, dua langkah granulasi terpisah dijalankan (masing-masing untuk komponen basa dan asam) dengan langkah pencampuran kering berikutnya.
- Proses pencampuran dapat menjadi tahap kritis dan dapat mempengaruhi homogenitas tablet karena tidak semua bahan terikat menjadi satu granul seperti pada proses granulasi basah konvensional.
- Reaksi effervescent hanya dimulai jika bahan bersentuhan dengan air - dan tidak jika bersentuhan dengan pelarut organik
- organik menawarkan sejumlah keuntungan, yang berasal dari panas penguapan yang lebih rendah jika dibandingkan dengan throughput air yang tinggi
- satu-satunya kelemahan dari metode ini adalah kebutuhan peralatan yang lebih kompleks untuk menangani cairan, sistem yang kompleks untuk pengolahan gas buang diperlukan. Ini tidak akan terjadi pada pengering pot tunggal karena hanya uap organik yang harus ditangani.
- Fluid Bed Spray Granulation Granulasi semprotan fluid
- bed adalah proses unik di mana granulasi dan pengeringan berlangsung secara bersamaan. Ini memastikan tingkat kelembaban rendah yang konstan, membatasi reaksi pra-effervescent seminimal mungkin.
- Sangat mudah untuk mencapai tingkat kelembaban akhir yang sangat rendah untuk penyimpanan.
- Pelumas
- Fungsinya untuk meningkatkan aliran bahan, yang sangat penting karena cetakan tablet press diisi dengan volume. Fungsi kedua adalah untuk mencegah tablet menempel pada permukaan punch atau ke dinding cetakan.
- Magnesium stearat tidak boleh digunakan karena tidak larut dalam air dan, akibatnya, lapisan film akan terbentuk di atas air setelah tablet larut.
- Kompresi Tablet Kompresi
- tablet effervescent berbeda dengan kompresi tablet normal.
- Untuk penyimpanan jangka panjang, diperlukan kadar air yang sangat rendah - biasanya kurang dari 0,3% air dibandingkan dengan sekitar 2% untuk tablet tradisional.
- Tablet effervescent biasanya berukuran cukup besar, yang sering menyebabkan kekerasan tablet tidak mencukupi dan akibatnya tablet pecah atau rusak
- Pengemasan
- Pengemasan Setelah bahan ditekan menjadi tablet, luas permukaan bahan telah berkurang secara signifikan, yang berarti bahwa laju kelembaban diserap dari udara juga telah berkurang.
- Aluminium, yang memiliki permeabilitas air yang rendah, digunakan sebagai pengganti bahan blister polimer standar.
- Jika sepuluh atau lebih tablet individual dikemas ke dalam satu tabung, udara yang sangat kering dapat ditambahkan tetapi saat pasien membuka tabung untuk mengeluarkan tablet pertama, udara lembab sekitar akan masuk dan menghancurkan tablet effervescent yang tersisa.
References
- Guidance for Industry Quality Systems Approach to Pharmaceutical CGMP Regulations , FDA, Sep 2006
- PIC/S guide to good practices, for the preparation of medicinal products in healthcare establishments, PE-0103, Oct 2008
- FailureAnalysisandPrevention,Vol11,ASMHandbook,ASMInternational, 1986, p 15–46
- Deviation Handling and Quality Risk Management, World Health Organization (WHO), Geneva, Switzerland , July, 2013